

Inteligencia artificial, ¿cómo evitaría los brotes de varicela?

El riesgo de adquirir varicela en la vida es superior al 95,1 %, especialmente durante la niñez. Foto: Alcaldía Municipal de Dosquebradas.

A comienzos de año, época que coincide con el inicio de clases, se presenta una de los picos de varicela más importantes del país. Foto: Nicol Torres, Unimedios.

El modelo matemático se podría aplicar para estudios de otras enfermedades infecciosas. Foto: Nicol Torres, Unimedios.
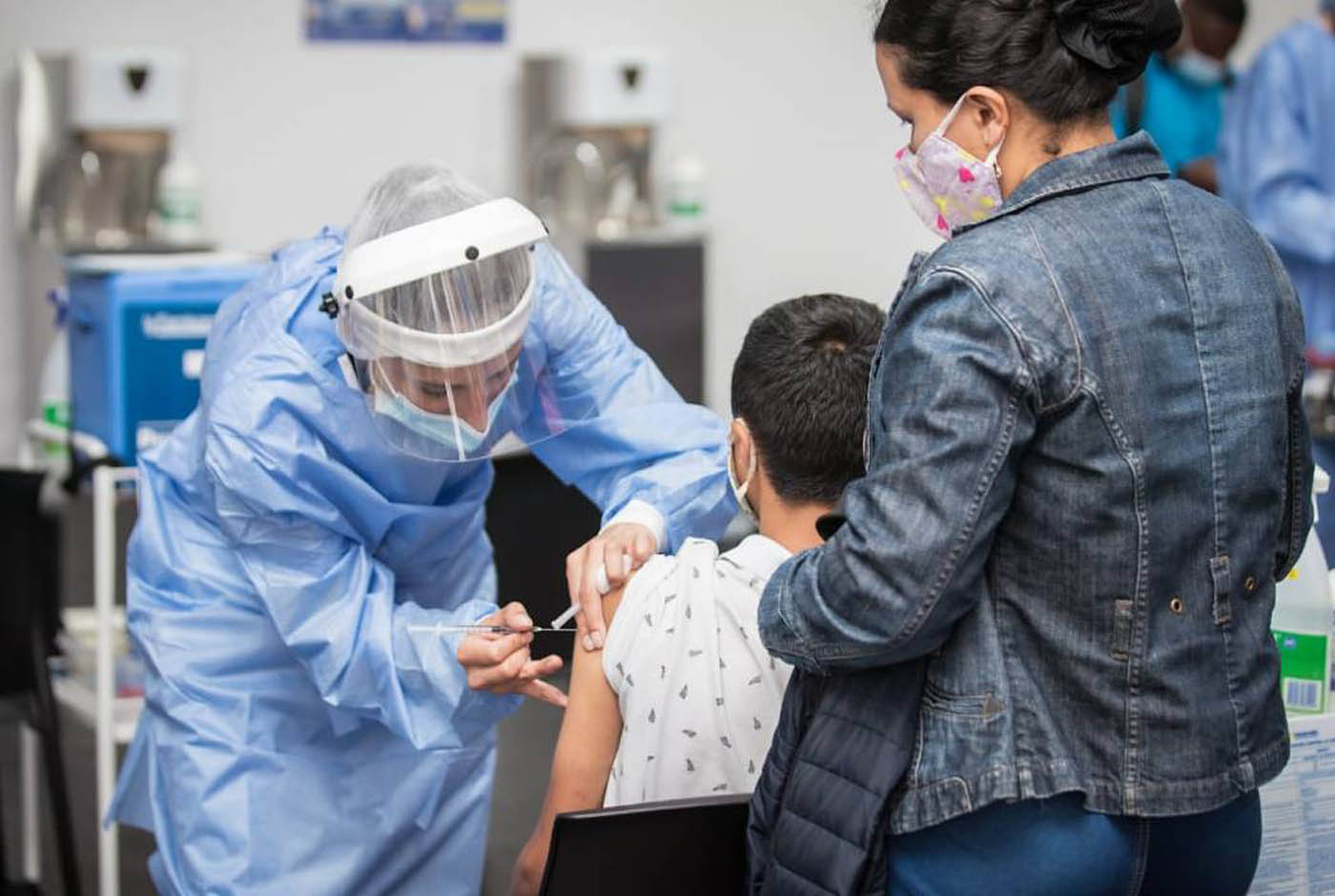
La forma más efectiva de prevenir la varicela es mediante la vacunación. Foto: Alcaldía Mayor de Bogotá.

Las ciudades grandes como Bogotá son más propensas a experimentar brotes de enfermedades virales como la varicela. Foto: Alcaldía Mayor de Bogotá.
Históricamente en Bogotá –con una población actual de más de 8 millones de habitantes– los casos de varicela han sido una preocupación importante; según expertos, factores como la alta densidad poblacional y el hacinamiento en algunas zonas favorecen su propagación, especialmente entre la población infantil. Según reportes del Instituto Nacional de Salud (INS), en 2022 se reportaron más de 4.000 casos en la ciudad.
Cabe destacar que la varicela puede tener complicaciones graves, especialmente en bebés, adolescentes, adultos, mujeres embarazadas y personas con sistema inmune débil. Por eso, aunque existe una vacuna efectiva, los brotes esporádicos son comunes y representan una carga significativa para los sistemas de salud pública en las grandes ciudades.
Ante esta evidente problemática, Gustavo Flórez Becerra, magíster en Ingeniería de Sistemas y Computación de la Universidad Nacional de Colombia (UNAL), desarrolló un método matemático útil para las simulaciones. Para ello, recurrió a la lógica difusa, utilizada por la inteligencia artificial y cuya función es hacer más manejables los problemas complejos que tienen información imprecisa o incompleta.
En este contexto se utilizó para representar la “naturaleza difusa e incierta” de algunos parámetros clave que influyen en la propagación de la varicela, como las tasas de transmisión basadas en el contacto y los factores ambientales.
Para construir el modelo, el investigador recopiló una amplia base de datos de los casos históricos de varicela individuales reportados en Bogotá por el INS de Colombia entre 2007 y 2020. Con ellos hizo un riguroso proceso de análisis estadístico mediante el cual se identificaron patrones muy particulares en el comportamiento de los contagios.
“Identificamos que los casos presentan dos picos importantes al año, que coinciden con los periodos de ingreso a clases escolares, cuando los niños tienen un mayor contacto entre sí. Esto marcó la pauta para que el modelo matemático desarrollado pudiera replicar adecuadamente esos patrones periódicos observados en los datos reales”, manifiesta el investigador.
Indica además que el modelo se basa en un enfoque de sistemas dinámicos, en el cual, mediante diferentes compartimentos o “tanques” se representan los estados de la población como susceptibles, expuestos, infectados, recuperados y vacunados.
Luego, con esa información y a través de un sistema de “ecuaciones diferenciales acopladas”, el modelo captura las transiciones e interacciones entre estos compartimentos que dan lugar a la propagación de la enfermedad.
Sin embargo, lo más innovador fue la inclusión de funciones periódicas específicas para modelar los componentes recurrentes identificados en los datos epidemiológicos.
“Probamos con diferentes funciones y ajustamos sus parámetros mediante un proceso de optimización hasta lograr que el modelo se aproximara muy bien al comportamiento real de los contagios”, destaca.
Un dato extra es que el modelo no solo simula el comportamiento esperado de los casos, sino que también permite explorar diferentes escenarios de intervención. Por ejemplo, si las autoridades de salud fijan un umbral máximo tolerable de casos en los periodos pico, este puede recomendar con anticipación los ajustes necesarios en las tasas de vacunación para mantener los contagios por debajo de ese umbral crítico.
“Nuestro objetivo es generalizar este enfoque de modelado y control inteligente para que se pueda aplicar a diversas enfermedades infecciosas con patrones periódicos o estacionales, como la influenza u otros virus respiratorios. Así se podría convertir en una herramienta versátil para apoyar a los decisores en la planeación de estrategias preventivas ante diferentes escenarios epidemiológicos”, concluye el investigador Flórez.